お知らせiPS細胞ストックプロジェクト 10年のまとめ論文公開
日本人の約40%に適合する再生医療用HLAホモドナー由来iPS細胞ストックを構築
ポイント
- 再生医療用iPS細胞ストックプロジェクトの成果をまとめる論文が2022年11月16日付(米国東部時間) で、科学ジャーナル「Med」のオンライン版に掲載された。
- これまでに、日本人で高頻度に見られるHLA型をホモ接合体で保有するドナー計7名の末梢血またはさい帯血からiPS細胞株を樹立し、品質試験の結果、選択した27株のiPS細胞ストックを構築した。これらは、免疫拒絶反応で重要なHLA-A, -B, -DRの3座において、日本人1位から4位までのHLA型をカバーし、日本人の約40%に適合する。
- iPS細胞ストックは、10以上の臨床試験で使用されており、これまでに移植細胞を原因とする有害事象は報告されていない。
- iPS細胞ストックは、研究用も含めて60以上の国内外の大学や企業に提供されており、治療法開発が進められている。
- GMP省令を始めとする各種規制に則った再生医療用iPS細胞に相応しい製造方法・品質評価方法を確立した。
1.要旨
再生医療における移植時の免疫拒絶を最小化するために、HLA(ヒト白血球抗原)(注1)-A, -B, -DRの3座をホモ接合体で持つドナーの血液から、臨床応用可能なiPS細胞を作製し、「再生医療用iPS細胞ストック」を構築しました。日本人における保有頻度が上位4位までのHLA型をホモ接合体で保有するドナー計7名の末梢血またはさい帯血からiPS細胞株を樹立し、品質試験の結果、選択した27株を提供しています。これらは、日本人の約40%のHLA型に適合したiPS細胞株です。
2015年の細胞提供開始以降、これらのiPS細胞株は10以上の臨床試験で使用されており、これまで移植細胞を原因とする有害事象が報告されていないことから、iPS細胞ストックが再生医療用原料として適切であると考えられます。本論文では、ここで構築したiPS細胞ストックの品質評価データ、製造に使用した試薬・資材、ドナーリクルートやドナー適格性確認の方法、iPS細胞ストックの提供先が実施した臨床試験の概要等をまとめています。品質評価試験の結果、選択されなかったiPS細胞の詳細データなど、iPS細胞製造において課題となる結果も公開しています。
2.研究の背景
iPS細胞は、体の様々な組織に分化する能力を有しており、多くの研究者がiPS細胞を原料とした分化細胞やオルガノイド(注3)などを作製し、様々な疾患に対しての治療法の開発に取り組んでいます。移植における免疫拒絶リスクの低減には、患者さん自身の細胞から作製したiPS細胞を使用することが望ましいですが、細胞製造・品質試験には時間とコストがかかります。その課題を解決する方法の一つとして、「多くの日本人にとって免疫拒絶反応が起こりにくいHLA型を持つドナー」に血液提供のご協力をいただき、末梢血もしくはさい帯血からiPS細胞を作製・保管し、これらを大学・研究機関や企業に提供することで、研究開発の時間短縮を図っています(図1)。
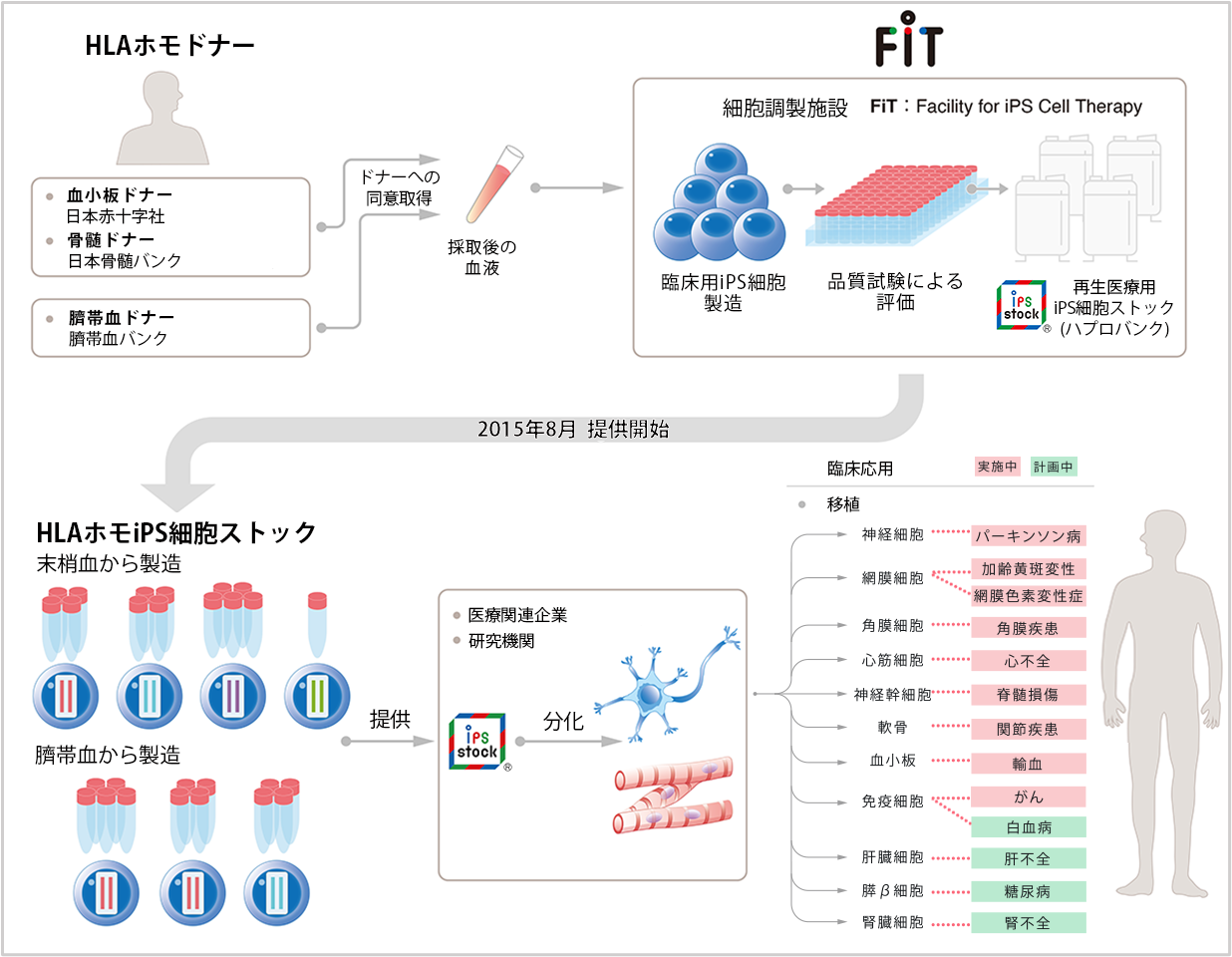
図1:再生医療用iPS細胞ストック構築の概要 (出典:Med)
3.研究結果
ドナーの適格性確認(問診や感染症検査)、規制に対応した製造方法、品質試験の項目・方法など、再生医療用途として適切なiPS細胞を構築する手法を確立し、厳格な品質評価を経て、7名のドナー由来の27株のiPS細胞ストックを構築・出荷しました。2021年末までに、HLA型をホモ接合体で保有するドナー47名に研究にご協力いただきました。この47名で、28種類のHLA型、日本人の約60%をカバーします。
iPS細胞の製造は、Method1の方法から大きく分けると2段階の変更を実施しました。Primary cell stock(PCS)からSecondary cell stock(SCS)を作製する際、より多くの合格株を得ることを目的としたsingle cell cloningの実施(Method2)と、製造時間の短縮および継代数の減少を目的とした、PCS作製時のcolony pick工程の削減実施(Method3)の2段階の変更を実施した計3つの方法に基づいてiPS細胞株を樹立しました(図2)。
作製したiPS細胞株において、品質評価の結果、選択されなかった理由の上位は、iPS細胞の樹立に必要なエピソーマルベクターの残存、ゲノム解析によって判明した癌関連遺伝子のSNV/indel(注4)、CNV(注5)および構造異常に加えて、未分化マーカー(注6)、核型変異(注7)などでした。一方、無菌試験を含む汚染検査などの規格試験で除外された株はありませんでした。また、同じ多能性幹細胞であるES細胞株と類似した形態や性質が見られることを確認しました(図3)。
エピソーマルベクターの残存は、PCSでのスクリーニングにおいて最も顕著な除外理由でしたが、Method2への変更により、明らかに残存レベルの低下の改善が見られました。
SNV/indelについては、異なるドナーからのPCSまたはSCSに共通する変異は同定されませんでした。このことからiPS細胞樹立時に特定の同じ遺伝子変異が導入されていないことが示唆されました。
CNVおよび構造異常については、11番染色体での特徴的な構造変異が検出されました。この結果は、我々のプロトコルによるiPS細胞の樹立・培養法に改善の余地があることを示唆されていると思われました。未分化マーカーについては、SSEA-4 and TRA-2-49では問題ない結果が得られているものの、TRA-1-60の低発現の為に、積極的には選択されなかった株が発生しました。
核型異常については、1名のドナーから作製したPCSの4割近くに検出されましたが、他のドナーではほとんど検出されませんでした。ドナー細胞の加齢の影響などに起因する可能性が示唆されていると思われました。更に各株の遺伝子発現データを、既存のiPS細胞やES細胞とも比較した解析を実施し、ドナーの男女差に起因すると思われる差以外は、顕著な差が見られないことを確認しました。複数株について、3胚葉系への分化を確認し、既存のiPS細胞やES細胞と同等の性質を持つことが確認できました。
当財団のiPS細胞ストックは、日本国内の再生医療に関する規制に適合することを優先にドナーの適格性確認を実施していたため、異なるドナー適格性要件が規定される米国での臨床使用の可能性は不明でした。しかしながら最近になって、米国の規制当局(FDA)により、特定の臨床試験にiPS細胞ストックを用いる際のドナーの適格性が認められました(詳細はこちらをご覧ください)。
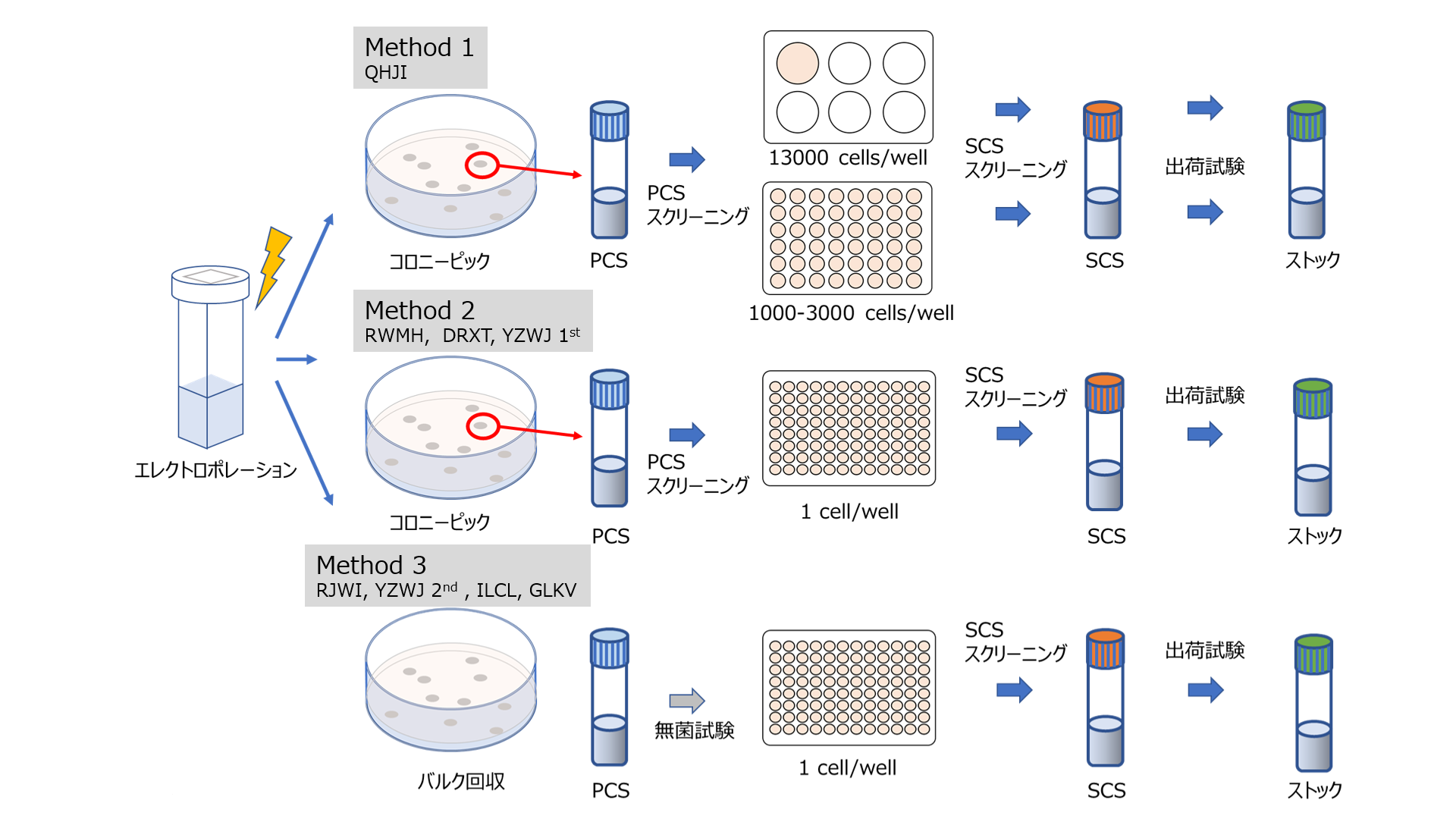
図2:iPS細胞ストックの作製方法 (出典:Med)
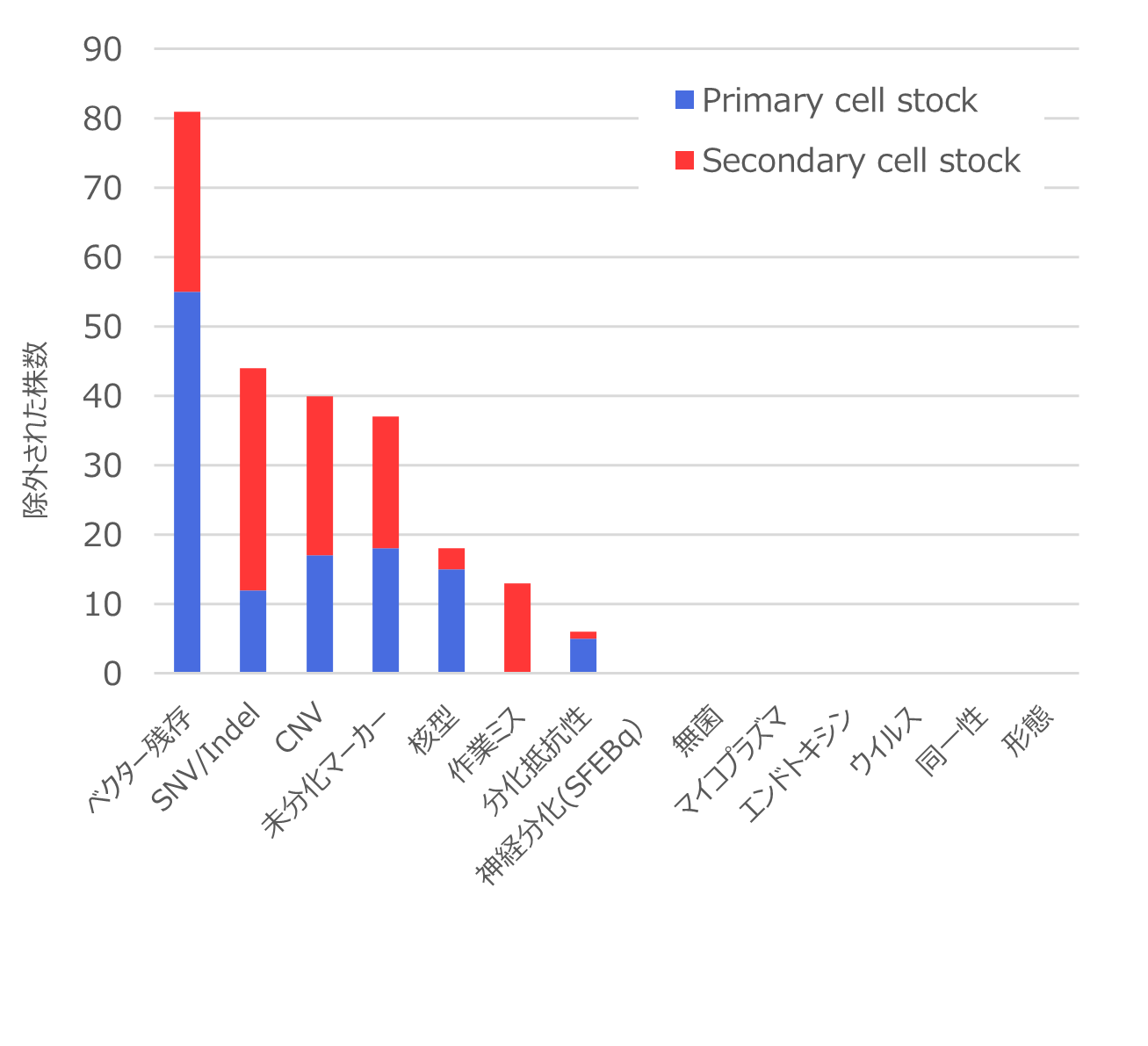
図3:除外理由と頻度 (出典:Med)
4.今後の展開・まとめ
2015年8月に最初の臨床用iPS細胞を出荷し、2017年3月に本細胞を用いた最初の臨床試験が実施されて以降、10以上の臨床試験(注8)(再生医療等安全性確保法下での臨床研究を含む)で患者さんに投与されています。最近では、患者さんの症状が改善された例も報告されています。今後も、当財団のiPS細胞ストックを提供した国内外の機関において、新たな疾患治療への試みが継続されることが期待できます。
加えて当財団では、日本人に留まらず世界中の方々に適合することを期待し、HLAをゲノム編集した医療用iPS細胞ストックの提供に向けて、現在製造を進めています。
また、患者さん自身の細胞からiPS細胞や治療用の分化細胞を作製して移植医療に提供するために、製造や品質評価に関する研究開発を進めています。これは拒絶反応のリスクを最小化するためには有効な手段となりますが、広く普及させるためには、時間・費用など、多くの課題があります。これらの課題を解決・克服し、自分自身のiPS細胞を用いた再生医療を一般化させるための技術開発を「my iPS®プロジェクト」と称し、企業や大学と連携しながら推進しています。
5.当財団理事長 (再生医療用iPS細胞ストック開発拠点 研究開発代表者)山中伸弥 コメント
再生医療用iPS細胞ストックプロジェクト開始から10年の節目を迎えるにあたり、これまでの成果をまとめた論文が科学ジャーナル「Med」に公開されることとなりました。この論文は、これからiPS細胞を用いた再生医療に参入される企業の皆様にとっても、大いに役立つものと期待しております。
iPS細胞ストック構築にあたり、細胞を提供していただいたドナーの皆様、またHLA型ホモ接合体ドナーを募集する際には日本赤十字社、公的さい帯血バンクおよび日本骨髄バンクからご協力をいただきました。その他にも、このプロジェクトは、寄付者の皆様、iPS細胞ストック提供先の研究機関や企業、政府関係者をはじめとする多くの方々のご協力なくしては実現不可能でした。これまでご協力くださった皆様、そして日々多くの励ましの声をお寄せくださっている皆様に、心より感謝申し上げます。
6.論文名と著者
・論文名
A clinical-grade HLA haplobank of human induced pluripotent stem cells matching approximately 40% of the Japanese population.doi.org/10.1016/j.medj.2022.10.003
https://www.cell.com/med/fulltext/S2666-6340(22)00450-0
・ジャーナル名
Med・著者
Shinsuke Yoshida1, Tomoaki M Kato1, Yoshiko Sato2, Masafumi Umekage1, Tomoko Ichisaka1, Masayoshi Tsukahara1*, Naoko Takasu1, Shinya Yamanaka1,2,3**責任著者
・著者の所属機関
1.京都大学iPS細胞研究財団(iPS財団)2.京都大学iPS細胞研究所(CiRA)
3.グラッドストーン研究所 循環器疾患部門
7.本研究への支援
本研究は、以下機関より支援を受けて実施されました。
日本医療研究開発機構(AMED)
再生医療実現拠点ネットワークプログラム(iPS細胞研究中核拠点)
8.用語説明
注1)HLA(ヒト白血球抗原)
免疫に関わる白血球の血液型として発見された。ほぼ全ての細胞が持ち、自分と他人、異常な細胞を見分ける目印となっている。注2)再生医療実現拠点ネットワークプログラム
日本発のiPS細胞技術を世界に先駆けて臨床応用に繋げるため、安全性・標準化に関する研究、再生医療用iPS細胞ストックの構築、疾患・組織別に再生医療の実現を目指す研究体制を構築し、オールジャパン体制で研究開発を推進するもの。(本文AMED HPより抜粋)注3)オルガノイド
試験管内など、体の外でつくった組織のことで、ミニ臓器とも呼ばれている。注4)SNV/indel (HLA)
SNVはSingle Nucleotide Variant(シングルヌクレオチドバリアント)の略。遺伝子の1ヶ所が置き換わっていること。 IndelはInsertion/Deletion(インサーション/デリーション)の略。遺伝子の一部が挿入または欠損により、通常と異なっていること。注5)CNV
Copy Number Variation(コピーナンバーバリアント)の略。遺伝子のコピー数が通常と異なっていること。注6)未分化マーカー
ヒトES/iPS細胞において高いレベルで発現していることが知られているため、培養したiPS細胞が未分化性を維持していることを確認するために使用されているマーカーのこと。注7)核型変異
核型とは人の細胞に含まれる染色体一式(23対計46本)を示した図のことを指し、その染色体の本数や構造が通常と異なっていること。注8)臨床試験
これらの中には、CiRAなどとの共同研究でCiRA_Fの細胞調製施設(FiT)で分化細胞の製造が実施されている臨床試験も含まれる。お問い合わせ先
研究・報道に関すること
公益財団法人 京都大学iPS細胞研究財団広報グループ
TEL:080-2359-8495
E-mail:contact*cira-foundation.or.jp
(お手数をおかけしますが、*を@に変えてください)
AMED事業に関すること
国立研究開発法人 日本医療研究開発機構(AMED)再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
TEL:03-6870-2220
E-mail:saiseinw*amed.go.jp
(お手数をおかけしますが、*を@に変えてください)
引き続き、当財団では、他機関のiPS細胞を用いた研究開発をサポートするとともに、独自の研究開発にも尽力して参ります。